- LifeSignals LX1550 다중매개변수 원격 모니터링 플랫폼에 대해 FDA 승인 획득
- 병원 및 가정환경 모두에서 지속적인 원격 환자 활력 징후 모니터링을 제공하는 회사의 능력을 입증한 또 다른 성과
프리몬트, 캘리포니아주, 2021년 7월 28일 /PRNewswire/ -- 27일, LifeSignals Inc.가 LifeSignals LX1550 다중매개변수 원격 모니터링 플랫폼에 대해 FDA Class II 510(k) 승인을 받았다고 발표했다. 이에 앞서 LifeSignals는 최근 CE 마크를 획득한 바 있다. 이번 FDA 승인은 임상의가 집이나 병원 환경에서 환자의 생리적 데이터를 지속해서 수집하는 데 사용 가능한 혁신적인 무선 플랫폼을 구축하고자 한 LifeSignals의 노력이 인정받은 또 다른 성과다.
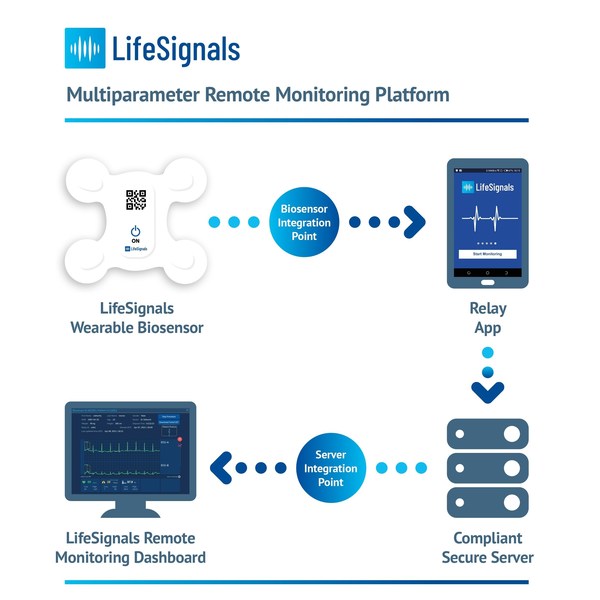
이 플랫폼의 핵심은 최대 5일간 심전도 기록(2채널 ECG), 심장박동, 호흡률, 피부 온도 및 자세 데이터를 기록하는 일회용 웨어러블 다중매개변수 바이오센서다. 암호화된 생리적 데이터는 중계 앱을 통해 바이오센서로부터 안전한 클라우드 기반 플랫폼으로 전송된다. 물론, 이 과정에서 높은 신뢰도를 보장한다. 임상의와 치료 제공자는 클라우드 기반의 원격 모니터링 대시보드에 접속해 환자의 생리적 데이터를 확인하고, 알림 환경을 관리할 수 있다.
이 원격 모니터링 플랫폼은 건강 기술 업체가 제품과 서비스 포트폴리오를 신속하게 개선하고, 위치에 상관없이 어디에서든 가장 광범위한 환자 기반에 활력 징후 모니터링을 제공할 수 있도록 설계됐다. 중계 앱과 대시보드는 설치 준비가 된 소프트웨어 개발 키트 API를 바탕으로 개발자 친화적이며, 대규모 시행에 적합하다.
LifeSignals 설립자 겸 CEO Surendar Magar는 "코로나19는 전 세계적으로 원격 환자 모니터링에 대한 장벽을 허물었다"라며 "자사 팀은 이처럼 단기간에 플랫폼을 개발한 것에 자부심을 느낀다"고 말했다. 그는 "FDA 510(k)의 승인은 회사의 개발 및 사명 여정에서 달성한 또 다른 중요한 이정표"라면서, "이 플랫폼은 이미 인도에서 코로나19 환자를 모니터링하는 용도로 여러 병원에서 성공적으로 시행됐으며, 유럽, 영국, 싱가포르 및 필리핀에서도 출시됐다"고 설명했다. 이어 그는 "현재 자사는 서비스를 확장하고, 환자 관리 개선을 희망하는 미국 건강 기술 업체에 저비용 원격 활력 징후 모니터링을 신속하게 소개하는 데 집중하고 있다"라고 덧붙였다.
사진 - https://mma.prnasia.com/media2/1582121/lifesignals.jpg?p=medium600